Unter schmerzhaften, entzündlichen Bedingungen konnte erstmalig eine vermehrte Expression von MR und GR auf schmerzleitenden peripheren und spinalen Neuronen, jedoch nicht in spinalen oder peripheren Gliazellen gezeigt werden. Während MR Agonisten eine erhöhte Schmerzsensitivität hervorrufen, bewirken MR-Antagonisten und GR-Agonisten eine signifikante Reduktion der Schmerzsensitivität, die sich jedoch nicht gegenseitig verstärken. Dabei handelt es sich um sofort eintretende, nicht-genomische Effekte. Diese Ergebnisse könnte man im Einklang mit der „Pendelhypothese“ von Hans Selye dahingehend interpretieren, dass sich pro- und anti-inflammatorische Effekte von GR und MR sowohl auf genomischer als auch auf non-genomischer Ebene als gegensätzliche Effekte wiederfinden.
Li X et al. 2018, Anesthesiology 128(4):796-809, PMID: 29356757, Web-Seite: https://pubmed.ncbi.nlm.nih.gov/29356757/
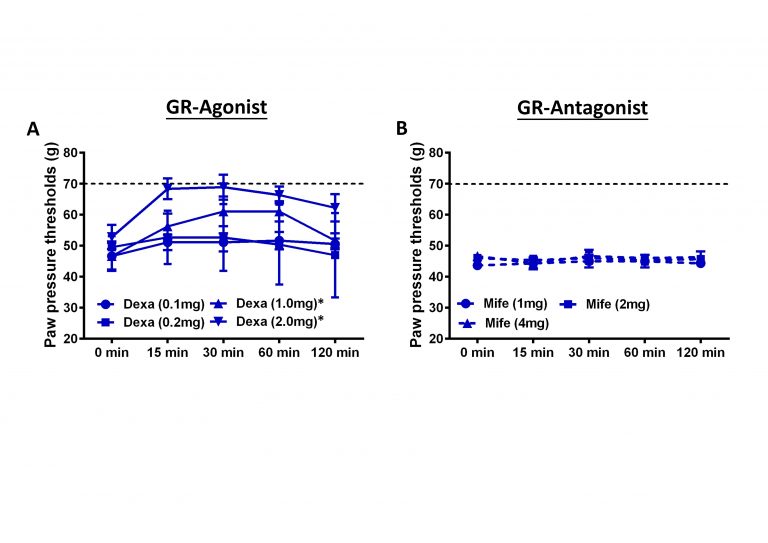
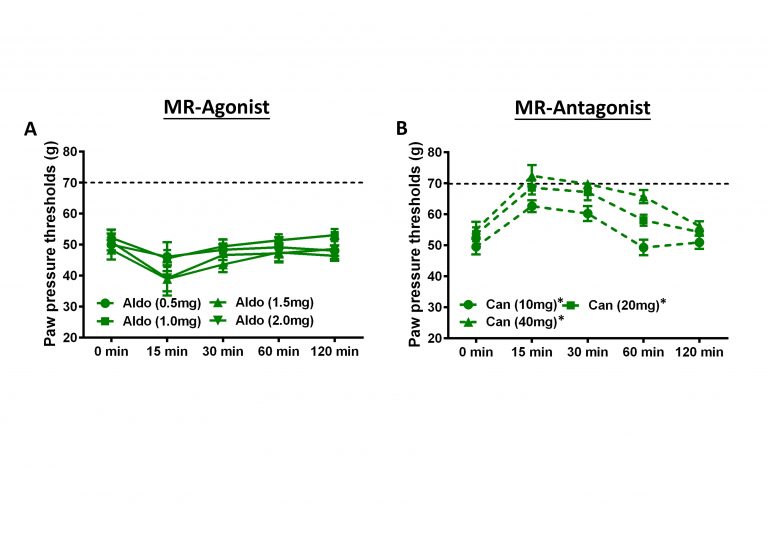
Diese Ergebnisse führten zu einer Untersuchung, ob sich diese tierexperimentellen Befunde auf den Menschen übertragen lassen.
Contribution of neuronal mineralocorticoid (MR) versus glucocorticoid (GR) receptors to pro- or antinociceptive effects in experimental inflammation


These results led to an investigation into whether these animal findings can be transferred to humans.